一、适用场景
乳胶微球表面带有羧基功能基团,可通过EDC介导的化学反应与含有氨基的蛋白或多肽形成酰胺键,实现蛋白与微球的共价偶联。
适用条件:
- 蛋白稳定性高、不易变性;
- 蛋白含氨基数量较少;
- 操作简便,适合大规模生产。
二、基本原理
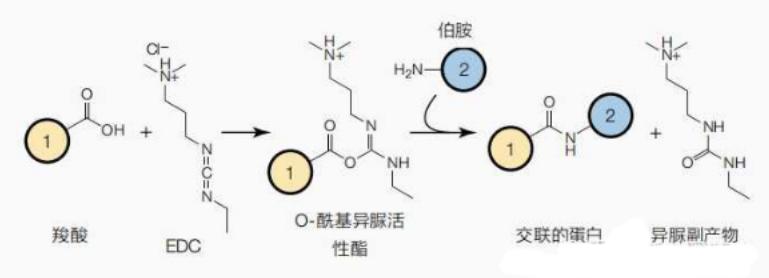
1.反应机制:
乳胶微球表面的羧基先与 EDC 反应生成活化的酯中间体,再与蛋白上的伯氨基反应生成酰胺键,实现共价偶联。
2.反应环境:
最佳反应 pH 为4.5–6.0(弱酸性环境)。
3.注意事项:
若蛋白同时含多个氨基和羧基,过量 EDC 可能导致蛋白交联失活,可使用羧基乳胶微球两步法共价法偶联蛋白调整方案。
三、注意事项
1. 缓冲体系:
禁用含氨基的缓冲液(如Tris缓冲液),推荐使用MES缓冲体系。
2. EDC适用规范:
- 防潮处理:使用前将EDC试剂瓶置于干燥器中升温至室温至少 30 分钟,避免水汽进入。
- 现用现配:EDC 水溶液半衰期短,需临用前配制。
3.抗体预处理:
- 抗体需不含 BSA 等蛋白类稳定剂及 Tris 等氨基缓冲盐,若含此类成分,需通过离心脱盐、超滤纯化去除。
- 高比例甘油可能影响偶联效率,建议预先去除。
四、基本流程(1 mg 蛋白偶联至 10 mg 微球)
1. 配制缓冲液
- 反应缓冲液(R Buffer):50 mM MES,pH 5.0(分出 2 mL 冰浴冷却)。
- 封闭缓冲液(B Buffer):50 mM HEPES,pH 7.4,1%(w/v)BSA。
- 储存缓冲液(S Buffer):50 mM HEPES,pH 7.4,1%(w/v)BSA,05%(w/v)Proclin® 300。
2. 微球预处理
- 将微球分散液混匀并平衡至室温,按固含量取 10 mg 微球至 2 mL 圆底离心管,用 R Buffer 稀释至1% w/v固含量。 例:若微球固含量为 10% w/v,取 1 mL 分散液 + 0.9 mL R Buffer;若为 5% w/v,取 0.2 mL 分散液 + 0.8 mL R Buffer。
3. 蛋白孵育
- 加入 1 mg 蛋白,颠倒混匀后,于 25℃混匀仪孵育 30 分钟。
4. 配制 EDC 溶液
- 称取 10–20 mg EDC 固体,用冰浴 R Buffer 溶解至浓度10 mg/mL(≈52 mM)。
5. 加入 EDC 溶液
- 按羧基总量的 5 倍摩尔比加入 EDC 溶液,充分混匀。 计算示例:若微球羧基密度为 100 μEq/g,10 mg 微球含羧基 1000 nmol,需 EDC 1500 nmol,对应 52 mM 溶液体积为 30 μL。
6. 反应与清洗
- 25℃混匀仪反应 2–4 小时,结束后 5000×g 离心 10 分钟(若未完全沉淀,增大离心力或延长时间)。
- 弃上清,加 5 mL R Buffer 重悬沉淀,重复清洗 3 次。
7. 封闭反应
- 加 5 mL B Buffer 初步重悬微球,冰浴下用探头式超声破碎仪(功率 200 W,超声 5 s / 间隙 5 s,总时长 10–15 分钟)充分打散。
- 25℃混匀仪封闭反应过夜。
8. 储存
- 离心弃上清,加 5 mL S Buffer 超声打散,4℃保存备用(离心转速和时间需根据微球粒径调整)。
五、常见问题
Q1:如何选择合适粒径的微球?
- 线性范围优先:选择小粒径微球(比表面积大,偶联抗体量多)。
- 灵敏度优先:选择大粒径微球(凝集时粒径变化显著,浊度信号高)。
Q2:如何判断微球是否完全打散?
- 方法:将微球用去离子水或 R Buffer 稀释至 1% w/v(粒径>200 nm时稀释至 0.05% w/v),测定 570 nm 吸光度(A0)。
- 对比:包被蛋白后,稀释至相同浓度测定吸光度(A1)。若 A1接近或略高于 A0,说明已打散;若A1远高于A0,可能为不可逆凝集,需降低微球浓度、调整EDC用量或改用两步法。

