做免疫试剂开发、抗体生物素化实验的科研人,大概率都踩过这些坑:偶联效率忽高忽低、检测灵敏度频频掉线,明明操作步骤没出错,实验结果却始终无法复现。其实背后藏着一个容易被忽略的“隐形元凶”——抗体聚集!
抗体作为生物实验的“核心选手”,在储存、运输或实验处理过程中,很容易悄悄“抱团”形成二聚体、多聚体甚至更大聚集体。这些看不见的聚集物会导致微球表面抗体覆盖不均,有效修饰表位减少,不仅拉低实验效率,还会干扰检测结果的准确性,让前期投入的时间和样本都白费。

想要精准识破抗体聚集的“小把戏”,动态光散射法(DLS)必须拥有姓名!作为科研圈公认的快速无损检测技术,它就像一双“火眼金睛”,能通过捕捉溶液中抗体布朗运动引发的散射光强度变化,结合Stokes-Einstein方程,精准算出抗体的流体力学直径和多分散指数(PDI),让聚集问题无所遁形。
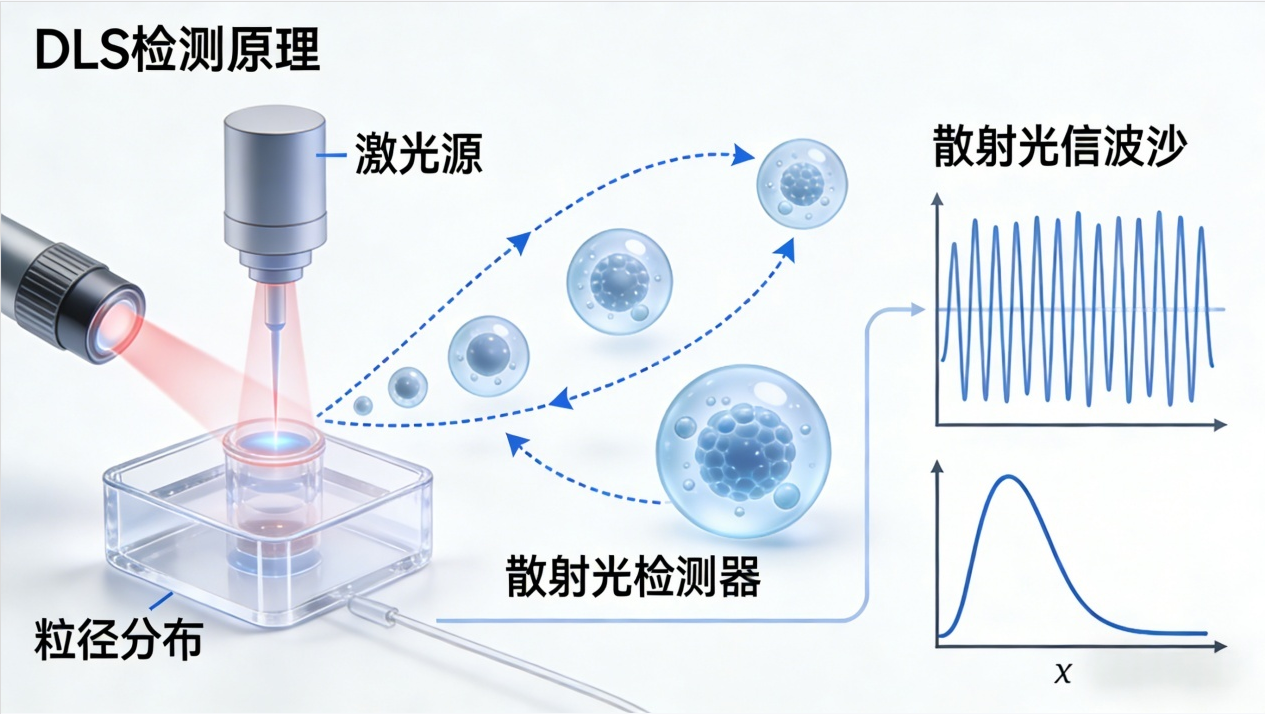
简单来说,激光照射样品后,小颗粒运动速度快,散射光信号波动衰减迅速,大颗粒则相反。通过解析相关函数曲线,就能清晰获取抗体粒径分布的核心信息,无需复杂处理,就能快速判断抗体状态。
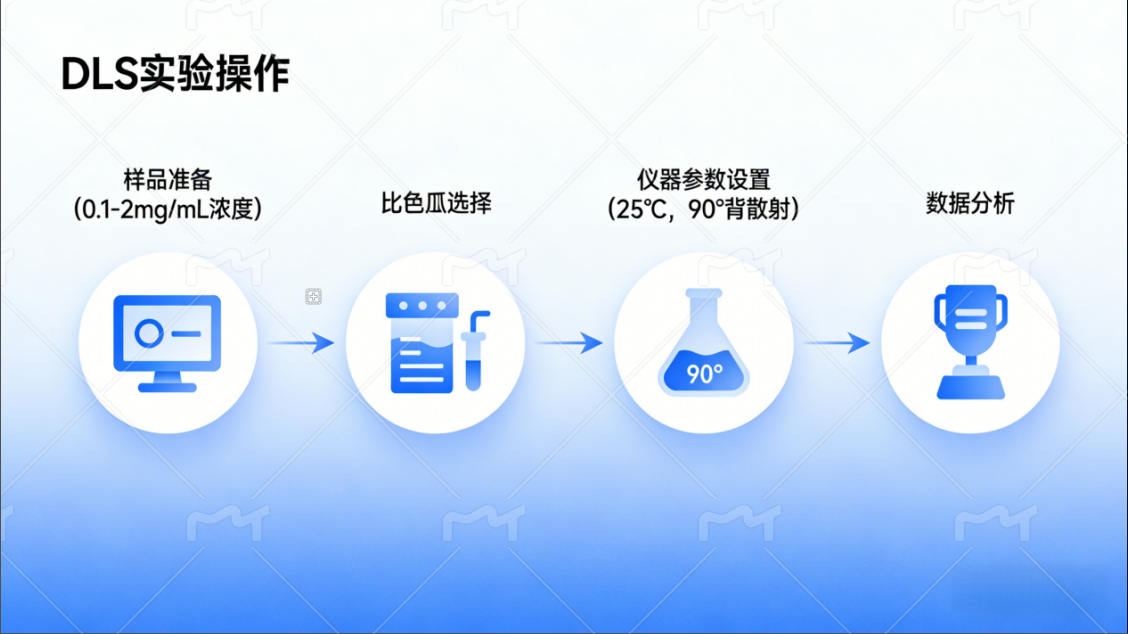
不过想要用DLS拿到可靠数据,测试前的准备工作得做足:
- 样品浓度建议控制在1-2mg/mL,最高不超过5mg/mL,还需验证不同稀释度的一致性;
- 比色皿可根据样品体积灵活选择,哪怕是2μL以下的超微量样品也能适配;
- 仪器设置上,25℃是常用温度,水溶液折射率默认33,选择90°或173°背散射检测,能减少多重散射对高浓度样品的影响。
拿到DLS报告后,重点盯紧三个核心指标就够了:
- 粒径分布:单体抗体主峰通常在10-15nm,15-30nm出现小峰可能是二聚体/多聚体,若出现大于100nm的峰则提示严重聚集;
- PDI值:≤0.05为高度均一样品,05-0.7含少量聚集,大于0.7则聚集严重,优质抗体的PDI应≤0.2;
- 单体比例:以主峰面积占比衡量,优质抗体需超过95%。
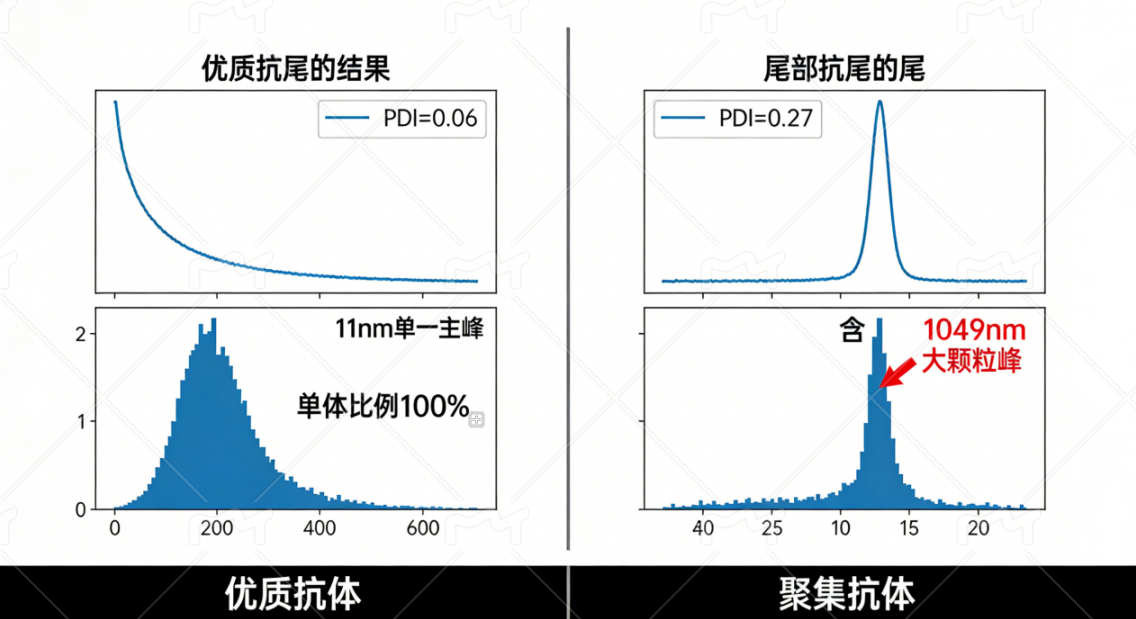
给大家举两个真实检测案例:某抗体的相关函数曲线在100μs内快速衰减,PDI仅0.06,11nm左右的单一主峰占比100%,属于分散性极佳的优质样品;而另一款样品虽衰减较快,但曲线尾部拖尾,PDI达0.27,还出现了1049nm的大颗粒峰,说明存在轻微聚集,不适合用于关键实验。
其实很多科研人都忽略了“实验前质控”这一步。在抗体偶联、生物素化等关键实验前,用DLS做一次快速检测,就能有效筛选出优质样品,从源头避免因聚集问题导致的实验返工。如果检测发现PDI大于0.3,建议结合SEC-HPLC/SEC-MALS进一步验证,确保实验基础扎实。
科研路上,细节决定成败。有了DLS这位“质控好帮手”,就能精准把控抗体状态,保障实验的可重复性和结果准确性,让抗体发挥最佳性能,帮你少走弯路、高效出成果!

